
РІЧНИЙ ЗВІТ 2019
Державного підприємства
«Державний експертний центр Міністерства охорони здоров’я України»
Наша місія
Забезпечити належну якість, ефективність і безпеку ліків для українців та створити умови
для раціональної фармакотерапії у сфері охорони здоров’я.

Тетяна Думенко
Директор Державного експертного центру МОЗ
2019 рік був багатим як на виклики, так і на успіхи. Державний експертний центр рухався до виконання своїх ключових задач: забезпечувати українців якісними, ефективними та безпечними ліками та через удосконалення процедур сприяти привабливості нашої держави для виробників ліків.
Це не відбувалось гладко. Через сфабриковані кримінальні справи здійснювався тиск окремих підрозділів правоохоронних органів на трудовий колектив. Це можна оцінювати як атаки на прозорість і відкритість у роботі ДЕЦ.
Та попри усі перешкоди, 2019 рік приніс низку нововведень.
Ми запустили новий формат роботи – Сервісний центр, та реалізували набагато зручніший підхід до роботи із заявниками. За рік Сервісний центр став обличчям нашого підприємства та прийняв близько 50 000 відвідувачів.
Ми розробили систему «Візуалізація» для заявників клінічних випробувань, щоби вони могли онлайн відстежувати всі етапи експертизи заяв і матеріалів.
Ми приєдналися до Європейської мережі оцінки медичних технологій. Це дозволяє адаптувати та використовувати сучасні міжнародні інструменти, щоби приймати обґрунтовані рішення при виборі ліків для державних закупівель та регуляторних переліків.
У 2019 році ми ще раз довели, що державне підприємство може бути успішним. Це виражається у 126 мільйонах гривень, сплачених до бюджету України податків та платежів – на 20% вище запланованого.
На 2020 рік ми ставимо перед собою амбітні, проте досяжні цілі. Це впровадження електронних форм комунікації: електронного кабінету заявника у системі з фармаконагляду, електронної форми реєстраційного досьє та повномасштабного електронного документообігу.
Нічого із досягнень 2019 року не сталося би без підтримки партнерів та друзів: Міністерства охорони здоров’я України, Державної служби України з лікарських засобів та контролю за наркотиками, Центру громадського здоров’я, Національної служби охорони здоров’я України, професійних асоціацій, міжнародних партнерів та громадських організацій.
І, нарешті, досягнення 2019 року є результатом роботи однієї команди – колективу Державного експертного центру МОЗ. Їхній професіоналізм, оптимізм та відданість спільній справі подолали тиск і забезпечили виконання завдань задля інтересів українських пацієнтів.
Ключові досягнення Державного експертного центру МОЗ у 2019 році

Відкриття Сервісного центру
Це новий формат співпраці із заявниками щодо реєстрації та перереєстрації лікарських засобів, який дозволив зробити процедури швидкими, прозорими та зрозумілими для виробників

Проривне збільшення кількості клінічних випробувань, що проводяться в Україні
Це відбулося дякуючи плідній роботі експертів ДЕЦ із удосконалення процедур для виробників

Членство у Європейській мережі оцінювання медичних технологій
Це дозволить використовувати сучасні міжнародні інструменти для прийняття рішень при виборі ліків для держзакупівель та регуляторних переліків
ДЕЦ – це команда із 614 експертів своєї справи та людей,
котрі прагнуть втілювати змінити тут і зараз заради
пацієнтів, виробників та держави

ПАЦІЄНТАМ
Відкривати доступ до якісних, безпечних та ефективних ліків кожному пацієнту

ВИРОБНИКАМ
Створювати рівні та прозорі умови гри на фармацевтичному ринку

ДЕРЖАВІ
Розбудовувати інвестиційну привабливість України та відкривати вхід для інноваційних ліків
ПАЦІЄНТУ
Робота ДЕЦ спрямована на відкриття доступу для пацієнтів до якісних, безпечних та ефективних ліків

Реєстрували та перереєстровували лікарські засоби

Відкривали доступ до інноваційних ліків через клінічні випробування

Щодня оновлювали інструкції для медичного застосування ліків у Державному ре�єстрі
Реєстрація та перереєстрація лікарських засобів



893 безпечних, якісних та ефективних лікарських засобів отримали висновки експертів для реєстрації в Україні. Завдяки роботі ДЕЦ сьогодні на українському ринку – майже 14 000 лікарських засобів (порівняно із 2018 роком зареєстровано на 10% більше лікарських засобів).



27 854 повідомлень про побічні реакції на ліки було зібрано в онлайн-режимі у 2019 році. Загалом із 1996 року ДЕЦ зібрав 226 077 таких повідомлень.
Вчасно інформуємо про небезпечну дію препаратів: при появі небезпечних побічних реакцій ініціюємо перед МОЗ припинення дії реєстрацію препарату.
Доступ до інноваційних лікарських засобів через клінічні випробування
20 тисяч пацієнтів мають можливість лікуватися безкоштовно інноваційними лікарськими засобами, знаходитися під постійним медичним наглядом та проходити безоплатно потрібні обстеження. За підсумками 2019 року в Україні триває 489 клінічних випробувань.




Онлайн доступ до інформації про ліки та лікування
Експерти ДЕЦ щодня оновлюють інформацію про зареєстровані лікарські засоби у Державному реєстрі. Із 2019 року пацієнт отримав можливість через електронну форму надіслати до Центру повідомлення про побічні реакції або відсутність ефективності ліків.
Третій рік ДЕЦ адмініструє роботу Реєстру клінічних випробувань ліків в Україні. Завдяки його простій та доступній структурі пацієнти можуть дізнатися про можливості долучитись до досліджень та безкоштовно отримати інноваційне лікування під наглядом лікарів-дослідників.
Із 2017 року ДЕЦ адмініструє Єдиний реєстр пацієнтів, які потребують інсулінотерапії. У цій інформаційній системі одночасно працюють лікарі-ендокринологи, представники аптечних закладів та департаментів охорони здоров’я Державних адміністрацій.
ВИРОБНИКУ
Робота ДЕЦ спрямована на створення для виробників рівних умов для виходу на фармацевтичний ринок через зручні та прозорі онлайн-інструменти

Реєстрували ліки за спрощеними та пришвидшеними процедурами

Займалися діджиталізацією: переводили процедури в онлайн режим

Підвищували прозорість експертизи клінічних випробувань

Відкрили
Сервісний Центр
Спрощені та пришвидшені процедури реєстрації лікарських засобів


130 лікарських засобів зареєстрували за спрощеною процедурою. Це майже у півтора рази (на 46%) більше, ніж минулого року. Це означає, що лікарські засоби, затверджені суворими регуляторними агенціями світу (FDA, MHRA, EMA, PMDA, Swissmed) потрапляють до пацієнтів України у коротші терміни. Це особливо цінно, коли на на ринку України аналогічні ліки відсутні.
Діджиталізація: переведення процесів в онлайн-режим
Удосконалили систему «Візуалізація» (система безкоштовного онлайн-доступу заявників для відслідковування проходження експертизи їхніх документів). Ми ввели в дію електронну форму заяви на зміни до свідоцтва про реєстрацію лікарських засобів. Таких заяв ДЕЦ приймає найбільше. Це дозволило суттєво скоротити час, який експерти витрачали на внесення заяв в електронну базу. На черзі впровадження такої форми для перереєстрації лікарських засобів.
Модернізували «Автоматизовану інформаційну систему з фармаконагляду». Тепер заявники можуть створювати в Системі електронний «Кабінет заявника», самостійно завантажувати xml-файли у форматі E2BR2 та E2BR3 та в будь-який час отримувати інформацію про несприятливі події після імунізації, побічні реакції на лікарські засоби, вакцини, туберкулін, які вони представляють на ринку України.
Введено прозорі процедури експертизи клінічних випробувань
У 2019 році вперше з 2012 року кількість затверджених міжнародних клінічних випробувань лікарських засобів в Україні перетнула межу в 200 та досягла 210 випробувань. Наразі в Україні проводиться 489 клінічних випробувань, в яких можуть взяти участь загалом до 20 000 пацієнтів.
Щоби це стало можливим, експерти ДЕЦ:
-
Розглянули 304 заяви на проведення клінічних випробувань
-
Внесли 1743 суттєвих поправок до протоколів клінічних випробувань
-
Надали 273 висновки за результатами експертизи і погодили до затвердження 249 матеріалів клінічних випробувань.
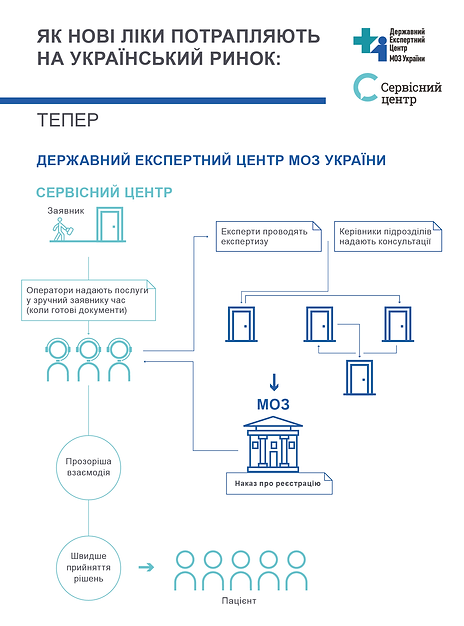
Відкриття Сервісного центру ДЕЦ
На початку березня 2019 року в Державному експертному центрі МОЗ України ми запровадили новий формат роботи із заявниками – Сервісний центр.
Це стандартна для європейських країн, але нова для України практика – коли державна експертна установа переходить на сервісний підхід у роботі із виробниками лікарських засобів.
-
У середньому Сервісний центр приймає на день 250 комплектів документів, які потребують заповнення чек-листа, а також низку окремих документів. За рік роботи зареєстровано понад 50 000 відвідувань.
-
Скоротили заборгованість по експертизі документів: на 14-62% по різних типах заяв (реєстрація, перереєстрація, внесення змін) та більш як на 90% по окремих напрямках (експертиза безпеки).




Вплив роботи Сервісного центру ДЕЦ:
-
Скоригували і систематизували алгоритми подачі документів для заявників. Відтепер заявники подають матеріали на експертизу тоді, коли вони готові. І не чекають кілька тижнів до вільної дати запису до експерта.
-
Для співробітників Центру час, в який вони можуть займатися експертизою, значно збільшився.
-
Усунули умови для виникнення корупційних ризиків.

ДЕРЖАВІ
Робота ДЕЦ спрямована на забезпечення експертизи лікарських засобів, підвищення інвестиційної привабливості через рівні конкурентн�і умови для всіх учасників ринку, самоокупність та наповнення державного бюджету податками та зборами

Створювали умови
для надходження інвестицій в українську економіку

Наповнювали державний бюджет

Впроваджували науково-обґрунтовані підходи у практику прийняття рішень

Створювали умови
для виходу нових інноваційних лікарських засобів
Забезпечуємо імплементацію міжнародних норм в українське законодавство
ДЕЦ активно працює над покращенням іміджу вітчизняної галузі клінічних випробувань і підвищенням її інвестиційної привабливості.
Аби покращити процедуру експертизи матеріалів клінічних випробувань ліків, оптимізувати її терміни та продовжити гармонізацію нормативно-правових актів України із законодавством Європейського Союзу, Центр направив до МОЗ проєкт змін та доповнень до Порядку проведення клінічних випробувань лікарських засобів (наказ 690). Ці зміни фахівці ДЕЦ підготували за результатами спільної роботи представників вітчизняних та закордонних виробників, Європейської Бізнес Асоціації та дослідників.
У 2019 році кількість затверджених міжнародних клінічних випробувань лікарських засобів в Україні перетнула межу в 200 та досягла 210 клінічних випробувань. Це сталося вперше з 2012 року – з моменту набрання чинності доповнень статті 3212 Кримінального Кодексу України. ДЕЦ відстоює позицію, що стаття потребує скасування, оскільки її норми не відповідають міжнародній регуляторній практиці.

Наповнюємо державний бюджет
Доводимо власними фінансовими результатами, що державне підприємство може бути успішним. Сплатили до держбюджету України в 2019 році 126,4 млн гривень.
Впроваджуємо науково-обґрунтовані підходи у практику прийняття рішень
Центр на постійній основі залучається до відбору лікарських засобів до номенклатури державних закупівель за бюджетні кошти. Спеціалісти Центру у 2019 році:
-
Визначали, як впливає на бюджет включення того чи іншого лікарського засобу до Національного переліку основних лікарських засобів. Для цього розробили спеціальний інструмент – калькулятор «Аналіз впливу на бюджет».
-
Працювали з визначенням критеріїв для пріоритетизації лікарських засобів, запропонованих для оцінки.
-
Розробили рекомендації щодо рівня впливу на бюджет.
Створили Департамент оцінки медичних технологій та приєдналися до Європейської мережі оцінки медичних технологій, щоби адаптувати до локальних умов та використовувати сучасні міжнародні методики та інструменти прийняття рішень: методи фармакоекономічного аналізу та моделювання, шкалу впливу на бюджет, мультикритеріальний аналіз прийняття рішень.
НАРОЩЕННЯ ЕКСПЕРТНОГО ПОТЕНЦІАЛУ ЦЕНТРУ ТА ГАЛУЗІ
Безперервно підвищували кваліфікацію фахівців ДЕЦ
Вивчали досвід іноземних країн із питань експертизи матеріалів та реєстрації лікарських засобів, долучалися до організації та проведення міжнародних симпозіумів, конференцій, семінарів.
Спеціаліст управління з біоеквівалентності ДЕЦ залучається в якості експерта до оцінок ВООЗ.
Передавали досвід фахівцям в Україні та з інших країн
Провели конференцію з фармаконагляду за участі представників регуляторних органів України та 6 країн СНД (Білорусі, Молдови, Азербайджану, Вірменії, Узбекистану), представника Європейського регіонального бюро ВООЗ, науковців та представники з питань фармаконагляду Великобританії, Швейцарії, фахівців з Нідерландів, Німеччини та США.
Активно працювали із заявниками, розробниками лікарських засобів та дослідниками за напрямком біоеквівалентності: регулярно проводили тренінги з експертами ДЕЦ. Зокрема, аби роз’яснити норми нової настанови з дослідження біоеквівалентності.
Фахівці ДЕЦ навчали спеціалістів в Азербайджані з питань зближення національного законодавства із законодавством ЄС.
Створили сайт «Фармацевтичного Журналу»: pharmj.org.ua, де містяться скановані PDF-версії статей за 1959–2010 роки, а також всі файли за 2019 рік.
Проходили аудити роботи Центру
Пройшли наглядовий аудит, аби підтвердити відповідність системи менеджменту якості Центру вимогам міжнародного стандарту ISO 9001:2015.
Пройшли незалежний фінансовий аудит.
Постійно проводимо роботу з оцінки, виявлення та усунення корупційних ризиків у діяльності Центру.
Набутий досвід та розбудований потенціал дозволяє Центру відповідати на виклики сьогодення, зокрема попередження поширення COVID-19.
І все це ми робимо заради того, аби пацієнт мав доступ до безпечних, якісних і ефективних ліків.
Наші досягнення ми розділяємо з нашими незмінними партнерами: Міністерством охорони здоров’я України, Державною службою України з лікарських засобів та контролю за наркотиками, Центром громадського здоров’я, Національною службою здоров’я України, професійними асоціаціями, міжнародними партнерами.
Дякуємо за сприяння у виконанні поставлених перед Центром завдань.
Віримо, що у 2020-му ми зробимо разом усе можливе заради здоров’я українських пацієнтів!

